
Intravenöse Lipidemulsionen müssen stabil und wirksam sein. Ein kritischer Faktor in diesem Zusammenhang ist der pH-Wert. (Bild: Anton Paar)
- Das Zetapotenzial ermöglicht eine gute Vorhersage für die Emulsionsstabilität von intravenöse Infusionen, die für die parenterale Ernährung oder als Träger für lipophile Arzneimittel zum Einsatz kommen.
- Mittels Partikelmessgerät analysierten die Forscher das Zetapotenzial, die Partikelgröße sowie die Transmission als Maß der Trübung.
- In dieser Untersuchung beeinflusste ein Erhöhen des pH-Wertes die Stabilität nicht. Im Gegensatz dazu, separierte die untersuchte Lösung umso stärker, je näher sich der pH-Wert dem isoelektrischen Punkt näherte.
Sie kommen bei der parenteralen Ernährung und als Träger für lipophile Arzneimittel zum Einsatz. Die Infusionen sind typischerweise Öl-in-Wasser-Emulsionen und bestehen aus einer wässrigen Phase, dispergierten Öltröpfchen sowie einem Emulgator. Während der Herstellung müssen intravenöse Emulsionen stabil bleiben und dabei Sterilisationsschritte aushalten oder die Zugabe von Osmosemitteln, pH-regulierenden Zusatzstoffen oder Konservierungsstoffen [1]. Bei instabilen Emulsionen treten unerwünschte Effekte auf, wie Flokkulation oder Koaleszenz, also ein Zusammenlagern der dispergierten Tröpfchen [2].
Ein entscheidender Stabilitätsfaktor für Öl-in-Wasser-Emulsionen ist die elektrostatische Ladung, welche durch das Zetapotenzial beschrieben wird. Partikel, die sehr positiv oder sehr negativ geladen sind, stoßen sich in Lösung ab und die Tendenz zur Flokkulation sinkt. Diese Partikel besitzen ein stark ausgeprägtes Zetapotenzial. Je größer der Absolutwert des Zetapotenzials, desto stabiler die partikuläre Lösung. Als Daumenregel gilt für viele Applikationen ein Absolutwert von größer 30 mV als Indikator für stabile Lösungen.

Abbauprozess einer Öl-in-Wasser-Emulsion bei abnehmender absoluter Partikelladung. Die Flokkulation ist ein reversibler Prozess – die Koaleszenz nicht.
pH-Wert als kritischer Parameter
Im Fall von Partikeln, für die H+ und OH–Ionen die Oberflächenladung definieren, besteht ein direkter Zusammenhang zwischen der Netto-Oberflächenladung der Partikel und dem pH-Wert des Dispergiermittels. Somit hat der pH-Wert einen enormen Einfluss auf die Stabilität von Emulsionen. Allerdings besitzen intravenöse Lipidemulsionen Einschränkungen hinsichtlich ihres möglichen pH-Werts, denn die pH-Stabilität der Komponenten muss berücksichtigt werden, um deren biologische Aktivität zu erhalten. Auch in Bezug auf die Verabreichung sollte der endgültige pH-Wert nahe dem physiologischen pH-Wert von 7,4 liegen.
Ein Partikelmessgerät – mehrere Messwerte
Um den Einfluss des pH-Werts zu untersuchen, analysierten die Labore von Anton Paar eine pharmazeutische Öl-in-Wasser-Emulsion zur intravenösen Applikation. Dafür verwendete das Unternehmen das Partikelmessgerät Litesizer 500 mit einem Flow-Modul und automatischem Dosing System. Messparameter waren das Zetapotenzial, die Partikelgröße sowie die Transmission als Maß der Trübung. Die Emulsion bestand aus einem stark fettlöslichen Medikament, Sojabohnenöl in Wasser als Lösungsvermittler sowie Eigelb-Lecithin als Emulgator. Mit deionisiertem Wasser wurde die Ausgangsprobe auf eine Endkonzentration von 0,0098% verdünnt und mit Natronlauge (NaOH, pH 12) oder Salzsäure (HCl, pH 1) titriert. Nach jedem Titrationsschritt wurde der pH-Wert automatisch gemessen, gefolgt von einer Zetapotenzial- und Partikelgrößenmessung bei 25 °C in einer Omega-Küvette.
Der pH-Wert der Ausgangsprobe lag bei 5,39, das mittlere Zetapotenzial bei etwa -30 mV und die mittlere Partikelgröße betrug über 200 nm, was einer stabilen Emulsion entsprach. Anschließend führte das Unternehmen Versuchsreihen durch; mit Titrationen zu größeren pH-Werten (Alkalisierung der Probe mit NaOH) oder kleineren pH-Werten (Ansäuerung der Probe mit HCl). Unter Zugabe von NaOH (Alkalisierung) ändert sich das Zetapotenzial auf -60 mV bei pH 9,35. Dies ist auf das Freiwerden von OH–Ionen zurückzuführen, wodurch sich die Nettoladung der Partikel erhöhte. Jedoch änderten sich weder die Partikelgröße noch die optische Transmission signifikant, was darauf hindeutet, dass die Stabilität der Emulsion bereits beim anfänglichen pH-Wert hoch war.
Niedriger pH-Wert senkt das Zetapotenzial
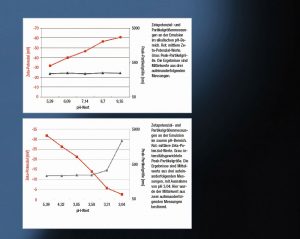 Der aufgrund des HCl niedrigere pH-Wert führte dazu, dass die absoluten Zetapotenzial-Werte abnahmen. Der Grund: die zugegebenen H+-Ionen neutralisierten die negativen Ladungen der Öltröpfchen. Bis zu einem pH-Wert von 3,58 und einem mittleren Zetapotenzial-Wert von -14 mV hatte dies kaum Einfluss auf die Emulsionsstabilität, was die unveränderten Peak-Partikel-größen und Transmissionswerte zeigen.
Der aufgrund des HCl niedrigere pH-Wert führte dazu, dass die absoluten Zetapotenzial-Werte abnahmen. Der Grund: die zugegebenen H+-Ionen neutralisierten die negativen Ladungen der Öltröpfchen. Bis zu einem pH-Wert von 3,58 und einem mittleren Zetapotenzial-Wert von -14 mV hatte dies kaum Einfluss auf die Emulsionsstabilität, was die unveränderten Peak-Partikel-größen und Transmissionswerte zeigen.
Bei pH 3,31 sanken die absoluten Zetapotenzial-Werte auf unter 10 mV und die Partikelgröße und Transmissionswerte nahmen zu. Dieser Trend verstärkte sich, je näher der pH-Wert dem isoelektrischen Punkt kam. Dabei fielen die Transmissionswerte auf unter 10 % und die Peak-Partikelgröße wuchs auf über 2.000 nm an. Dies deutet darauf hin, dass die Öl-in-Wasser-Emulsion separierte: Zunächst konnten die Forscher eine Flokkulation beobachten, also eine moderate Erhöhung der Teilchengröße bei pH 3,31 und schließlich eine Koaleszenz in Form eines starken Anstiegs der Partikelgröße bei pH 3,04 nahe des isoelektrischen Punktes.
Die Transmissionswerte ergaben einen Hinweis auf die Stabilität der Emulsion, wobei die Zunahme der Partikelgröße unmittelbar dazu führt, dass sich die Lösung trübte, was sich in einer sinkenden Transmission darstellte.
Fazit: Das Zetapotenzial ermöglicht eine gute Vorhersage für die Emulsionsstabilität. Außerdem hat die Untersuchung ergeben, dass die Alkalisierung die Stabilität nicht beeinflusst. Im Gegensatz dazu zeigte ein Ansäuern, dass die Stabilitätsgrenze der Emulsion bei etwa pH 3,5 liegt, was einem Zetapotenzial von -10 mV entspricht. Unterhalb dieses pH-Wertes gab es eine Zunahme der Partikelgröße und eine gleichzeitige Abnahme der optischen Transmission: Die Emulsion separierte. Der niedrigste pH-Wert bei pH 3,04 lag sehr nahe am isoelektrischen Punkt der Emulsion, wobei ein deutlicher Anstieg der Partikelgröße die bevorstehende Zersetzung der Emulsion andeutete.
HINTERGRUND
Der isoelektrische Punkt
Der isoelektrische Punkt (IEP) ist definiert als der pH-Wert, am dem Partikel keine Nettoladung tragen; Das Zetapotenzial ist hier Null. In der Nähe des IEPs übersteigen attraktive Kräfte zwischen Partikeln deren Abstoßung, was zu Partikelaggregation und Flokkulation führt. Für pH-Werte unterhalb des IEPs tragen die Partikel eine positive Ladung und umgekehrt. Damit stellt der pH-Wert einen kritischen Parameter für partikuläre Lösungen dar.
Die Autoren:
Nathalie Etchart-Liechtenstein, Technical Documentation, Anton Paar
Carina Burgstaller, Product Specialist, Anton Paar
Bastian Arlt, Product Specialist, Anton Paar Germany
Powtech Halle 1 – 456
Referenzen
[1] Leal-Calderon F., V. Schmitt & J. Bibette (2007). Emulsion science: basic principles. Springer Verlag, Berlin.
[2] Astier A. (2015). Issues in stability of drugs for infusion. http://www.hospitalpharmacyeurope.com/featured-articles/issues-stability-drugs-infusion
[3] Müller, R. H. (1996). Zetapotential und Partikelladung in der Laborpraxis. Wissenschaftliche Verlagsgesellschaft, Stuttgart.